Informator
Vakcine sadrže oblik uzročnika bolesti, bilo da je to oslabljeni ili ubijeni oblik samog mikroba, inaktivisana verzija njegovih toksina ili protein sa površine mikroba. Unošenjem oblika agensa vakcinom, antigen se predstavlja imunom sistemu kao strani uljez sa namerom da ga imuni sistem prepozna i razvije antitela i memorijske T-limfocite protiv njega.
To bi trebalo da omogući brži i snažniji imuni odgovor ukoliko bi organizam u budućnosti bio izložen istom organizmu.
Vakcine utiču na imuni sistem, prvenstveno putem B-limfocita i T-limfocita. Pre izlaganja, imuni sistem sadrži B-limfocite i T-limfocite, od kojih svaki ima potencijal da odgovori na jedinstveni antigen. Mnogi antigeni zahtevaju kombinovani odgovor i B-limfocita i T-limfocita. Ovaj oblik imuniteta naziva se zavisnim od T-ćelija. Ređe, antigen izaziva stimulaciju B-limfocita i proizvodnju antitela bez pomoći T-limfocita. Ovaj oblik imuniteta naziva se nezavisnim od T-ćelija.
Na početku procesa, vakcinom se u telo uvodi antigen koji podstiče pokretanje imunog odgovora. U početku se strani materijal fagocituje i razgrađuje makrofagama. [ 1 ] [ 2 ] [ 3 ] [ 4 ] Rezultirajući peptidi stvoreni razgradnjom proteinskog materijala se šalju na površinu ćelije makrofaga, gde se prikazuju. Ovi antigeni su prikazani molekulima koji se nazivaju glavni histokompatibilni kompleks (kompleks proteina koji se nalaze na površini ćelija i koji vezuju strane proteine za sebe i tako ih čine prepoznatljivim za odbrambeni sistem organizma). Prezentacija antigena stimuliše lučenje nekoliko upalnih medijatora, uključujući citokine i različite interferone, koji podstiču dalju reakciju.
U imunitetu zavisnom od T-ćelija, takozvane T-pomoćne ćelije prepoznaju antigen i stimulišu odgovarajuće B-limfocite da proliferišu (množenje ćelije deljenjem) i stvaraju antitela. Kako se B-limfociti razmnožavaju, oni se takođe diferenciraju u plazma ćelije koje formiraju antitela. Proizvedena antitela imaju različite funkcije od kojih najvažnije uključuju one koji inaktiviraju topive toksine proteina (antitoksine), one koji olakšavaju unutarćelijsko varenje bakterija oštećujući bakterijsku membranu (lizini), one koji sprečavaju reprodukciju patogenih virusa (neutrališuća antitela) i one koje sprečavaju adheziju (prijanjanje) bakterija na površini sluznice. Kao odgovor na vakcine, prva proizvedena antitela su pre svega IgM, s postepenim prelaskom na IgG u narednim nedeljama.
[ 5 ] [ 6 ] [ 7 ]
Imunitet delimo na aktivni i pasivni.
Aktivni prirodni imunitet nastaje nakon prirodnog izlaganja organizma izvorno specifičnom agensu, odnosno prebolevanjem neke bolesti.
Aktivni veštački imunitet se forsira vakcinacijom.
Pasivni prirodni imunitet se prenosi sa majke na dete preko placente ili majčinog mleka.
Pasivni veštački imunitet se uglavnom prenosi pomoću seruma dobijenih od životinja (npr. TOTEKVIN® / VIEKVIN®) i humanih imunoglobulina (npr. HBIG / Tetagam® / HRIG ) dobijenih od imunizovanih donora ili rekovalescenata, čiji je organizam tokom izlaganja patogenu stvorio antitela.
Samim tim, koriste se dva metoda veštačke imunizacije:
- Aktivna imunizacija (vakcine koje imaju funkciju da forsiraju imuni sistem pacijenta da sam stvori antitela protiv nekog patogena).
- Pasivna imunizacija je indikovana kod pacijenata koji ne mogu da formiraju antitela, poput onih sa oslabljenim imunim sistemom (imunokompromitovani). Takođe je indikovana kada se bolest može razviti pre nego što je aktivni imunitet sposoban da razvije antitela, kao što je slučaj kod pacijenata izloženih besnilu. U ovom slučaju pacijentu se daje vakcina protiv besnila (aktivna imunizacija) i HRIG (pasivna imunizacija), kako pacijent ne bi razvio besnilo pre nego što aktivna imunizacija efikasno stvori antitela.
U zavisnosti od tipa antigena, odnosno od tehnologije dobijanja antigena koje sadrže, vakcine klasifikujemo na:
Atenuisane virusne vakcine koje sadrže živi virus koji je oslabljen tokom procesa proizvodnje tako da ne bi trebao da izazovu stvarnu bolest kod osobe koja je vakcinisana. Nose potencijalni rizik od ispoljavanja virulencije patogena kod osetljivih primaoca kao i mogućnost reverzije atenuacije. Ne preporučuju se osobama sa oslabljenim imunim sistemom. Primer: M-M-RVAXPRO®, Varilrix® i Rotarix.
Atenuisane bakterijske vakcine sadrže žive oslabljene bacile. Primer: BCG vakcina
Atenuisane toksoidne vakcine sadrže toksoide (oslabljeni toksini mikroorganizama). Primer: IMOVAX DT ADULT i TETAVAKSAL-T®
Inaktivisane virusne vakcine sadrže virus koji je ubijen da ne izazove bolest, ali telo ga i dalje prepoznaje i podstiče proizvodnju antitela protiv njega. Imuni odgovor je znatno slabiji i traje kraće u odnosu na atenuisane (žive) vakcine. Zato je neophodno da sadrže adjuvans i da se daju u više doza. Preporučuju se pojedincima sa oslabljenim imunim sistemom. Primeri: AVAXIM® 160 U, Imovax Polio.
Podjedinične vakcine (sadrže prečišćene delove mikroorganizama) – U nekim slučajevima, ceo virus ili bakterija nisu potrebni za imuni odgovor. Potrebni su samo važni delovi, deo ili „podjedinica“ bakterija ili virusa koji izazivaju bolest. Dobijaju se prečišćavanjem mikroorganizama ili korišćenjem genetičkog inženjeringa (rekombinantnom tehnologijom – rDNK). Pošto podjedinične vakcine ne sadrže sve delove mikroorganizma, mora im se dodati adjuvans i daju se u više doza.
- Vakcine na bazi proteina – Primer mogu biti rekombinantne vakcine koje su napravljene genetskim inženjeringom, postupkom i metodom manipulacije genetskim materijalom organizma. Korišćenjem rDNK tehnologije, gen koji kodira željeni protein (vakcinalni antigen) se ugrađuje u vektor za kloniranje (plazmid), i tako nastala rekombinantna DNK se unosi u odgovarajuće ćelije (često su to bakterije E. coli ili kvasnice), koje se kultivišu na hranljivim podlogama, čime se obezbeđuje sinteza velikih količina proteina od interesa (proteina za vakcinu). Protein od interesa se zatim izoluje, prečišćava, kombinuje sa adjuvansom i drugim ekscipijensima i inkorporira u vakcinu. Primer: Euvax B®, Synagis®, Gardasil®.
- Vakcine na bazi polisaharida – Polisaharidne vakcine kao glavne antigene sadrže polisaharide (obično iz kapsule bakterija). Polisaharidi su slabo imunogeni. Međutim, za vakcine sastavljene isključivo od pročišćenih polisaharida smatra se da su efikasne samo kod starije dece i odraslih. Primer: Pneumovax 23
- Vakcine na bazi konjugata polisaharida i proteina – Smatra se da vakcine napravljene samo sa polisaharidima nisu efikasne kod male dece jer njihov imuni sistem nije u potpunosti razvijen, stoga su napravljene konjugovane vakcine, kod kojih je polisaharid jednog patogena vezan za proteinski nosač koji je imunogen, najčešće difterijski ili tetanusni toksoid ili neki površinski protein bakterija. Primer: Act-HIB®, Nimenrix, Prevenar 13®.
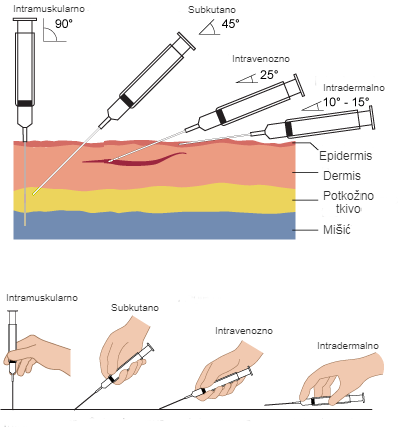
Vakcine se aplikuju enteralno (oralno) ili parenteralno (putem igle).
Parenteralni načini (putem igle) su:
- Intramuskularno
- Subkutano
- Intradermalno
Prosto rečeno, kontraindikacije predstavljaju nepoželjno stanje organizma za neki lek ili medicinsko sredstvo odnosno preosetljivost na aktivnu supstancu ili na bilo koju od pomoćnih supstanci.
Primer: Primenu Euvax B vakcine je potrebno odložiti u slučaju akutne bolesti, praćene povišenom temperaturom. Kod pacijenata koji pate od multiple skleroze, bilo kakva stimulacija imunog sistema može indukovati pogoršanje simptoma bolesti. Usled toga, kod ovih pacijenata, potrebno je proceniti korist od vakcinacije protiv hepatitisa B u odnosu na rizik od pogoršanja multiple skleroze.
Neželjena reakcija jeste svaka štetna i nenamerno izazvana reakcija na lek koja se pojavila pri primeni uobičajene doze leka kod ljudi (u svrhu lečenja, sprečavanja bolesti, postavljanja dijagnoze, obnove, poboljšanja ili promene fiziološke funkcije), ili pri primeni bilo koje doze leka u toku kliničkog ispitivanja.
Neočekivana neželjena reakcija jeste reakcija na lek čija priroda, ozbiljnost ili ishod nisu opisani u sažetku karakteristika leka, odnosno brošuri za istraživača za lekove koji su u kliničkim ispitivanjima.
Neželjeni događaj jeste neželjeno iskustvo koje se dogodilo u periodu primene leka i za koje uzročno-posledična veza sa primenom leka ne mora da bude dokazana. Neželjeno iskustvo predstavlja bilo koji nenameravani i neželjeni znak (npr. abnormalni laboratorijski nalaz), simptom ili bolest, vremenski povezan sa primenom leka.
Ozbiljna neželjena reakcija/neželjeni događaj jeste svaka neželjena reakcija/neželjeni događaj koji imaju za posledicu:
- smrt,
- neposrednu životnu ugroženost,
- trajno ili teško oštećenje/invalidnost,
- bolničko lečenje ili produžetak postojećeg bolničkog lečenja,
- kongenitalne anomalije, odnosno defekt otkriven po rođenju,
- drugo medicinski značajno stanje.
Interakcija jeste promena farmakokinetičkih ili farmakodinamičkih svojstava leka uzrokovana istovremenom primenom drugog leka, hrane, ili neke druge supstance.
Ovo je spisak poznatih neželjenih reakcija kod vakcina koje se daju po kalendaru obavezne imunizacije dece u Republici Srbiji:
(Ostale vakcine koje nisu obavezne nisu uzete u obzir)
- Afebrilne konvulzije ili epileptički napadi,
- Agitirnost
- Alergijske reakcije (osip, svrab, koprivnjača)
- Alopecija
- Anafilaktoidne reakcije
- Angioneurotski edem
- Anoreksija
- Apsces
- Apnea
- Artritis
- Artralgija
- Aseptični meningitis
- Astenija
- Ataksija
- Atipične male boginje
- Atrofija
- Bol
- Bol u grlu
- Bol u stomaku
- Bol u uhu
- Bol u zglobovima
- Branhijalni neuritis
- Bronhospazam
- Dijareja
- Dispepsija
- Dizurija
- Edem
- Ekcem
- Encefalitis
- Encefalitis sa inkluzionim telima posle infekcije virusom malih boginja (MIBE)
- Encefalopatija
- Epididimitis
- Eritem
- Eritematozni osip
- Erythema multiforme
- Erythema nodosum
- Facijalna paraliza
- Faringitis
- Febrilne konvulzije
- Gađenje
- Glavobolja
- Groznica
- Gubitak apetita
- Guillain-Barre sindrom
- Hematom
- Herpes zoster
- Hiperbilirubinemija
- Hipoestezija
- Hipotenzija
- Hipotonično-hiporesponzivna epizoda
- Induracija
- Infekcija gornjeg respiratornog trakta
- Inflamacija
- Infiltrat u obliku čvorića
- Iritabilnost
- Insomnija
- Jeza
- Kawasaki-jeva bolest
- Keratitis
- Konjunktivitis
- Konstipacija
- Konvulzije (uključujući i febrilne napade)
- Kožne ospe
- LE sindrom
- Lezije korena nerava (radikulopatija)
- Limfadenopatija
- Lupoidne kožne promene
- Makulo-papularni osip
- Migrena
- Mijalgija
- Mijelitis
- Monilijaza
- Morbiliformni raš ili druge vrste raša
- Nazofaringitis
- Nauzeja
- Nekroza
- Nervoza
- Neuobičajeni plač
- Neuritis
- Neuropatija
- Nervna gluvoća
- Očna paraliza
- Optički neuritis
- Opšta slabost
- Orhitis
- Osteitis ili osteomijelitis
- Otitis media
- Ošamućenost
- Ožiljci
- Palpitacije
- Panikulitis
- Papilitis
- Paraliza
- Parestezija
- Pareza
- Parotitis
- Pityriasis rosea
- Plikovi
- Pneumonija
- Pneumonitis
- Pogoršanje MS
- Pojačano znojenje
- Polineuritis
- Polineuropatija
- Poremećaj funkcije jetre
- Poremećaj vida
- Poremećaji na nivou krvi i limfnog sistema (neutropenija)
- Pospanost
- Povećan ESR
- Povećanje transaminaze
- Povišeni enzimi jetre
- Povraćanje
- Promene osetljivosti na toplotu
- Pruritus
- Purpura
- Razdražljivost
- Regionalna limfadenopatija
- Retinitis
- Retrobulbarni neuritis
- Rigor
- Rinitis
- Rinoreja
- Serumska bolest
- Simptomi slični gripu
- Sindrom sličan MS
- Sinkopa
- Slabost
- Slabost u mišićima
- Somnolencija
- Stevens-Johnson sindrom
- Subakutni sklerozni panencefalitis
- Supurativni limfadenitis
- Tahikardija
- Tinitus
- Trombocitopenija
- Ukočenost
- Ulceracija
- Uporan plač
- Urtikarija
- Uvećanje limfnih čvorova
- VAPP-Vaccine Associated Paralytic Poliomyelitis
- Vaskulitis
- Vrtoglavica
- Zatvor
- Žarenje
- Žutica
Vakcina koja nije po kalendaru obavezne imunizacije ali se daje deci kao preventiva protiv respiratornog sincicijalnog virusa jeste vakcina Synagis®.
Kod ove vakcine kao jedna od neželjenih reakcija navedena je smrt. 4.4.
Uputstvo za nadzor nad neželjenim događajima nakon imunizacije
Nijedan lek nije apsolutno bezbedan. Drugim rečima, nijedan lek nije oslobođen rizika. Neželjene reakcije mogu da prate svaku terapijsku primenu lekova. Iako su mnogi od rizika poznati u trenutku registracije leka, neke informacije o njegovom bezbednosnom profilu izlaze na svetlo kasnije, nakon stavljanja leka u promet i povećanja njegove primene.
Pre nego se lek stavi u promet, informacije o njegovoj bezbednosti su ograničene jer potiču od njegove upotrebe u kliničkim ispitivanjima pod specifičnim, strogim i organizovanim uslovima, koji nužno ne reflektuju način njegove primene u svakodnevnoj rutinskoj zdravstvenoj praksi, kada se lek nađe u prometu. Uprkos obimnim premarketinškim ispitivanjima, pretkliničkim na životinjama i kliničkim ispitivanjima na ljudima, neke neželjene reakcije se ne mogu evidentirati ukoliko veliki broj pacijenata nije primio lek.
Zato je od velikog značaja praćenje bezbednosti svih lekova od njihovog stavljanja u promet i to nazivamo farmakovigilanca.
Krajnji cilj farmakovigilance je zaštita javnog zdravlja, stavljajući bezbednost pacijenta u sam fokus. Zato je farmakovigilanca esencijalna u regulatornom sistemu lekova.
U Srbiji, ALIMS je nadležna za praćenje neželjenih reakcija na lekove.
U tom pogledu, ALIMS uspostavlja, kontinuirano održava i unapređuje nacionalni sistem farmakovigilance u Srbiji. Ovaj sistem treba da omogući detekciju bezbednosnih signala, identifikaciju rizika, njihovu karakterizaciju, procenu, minimizaciju, komunikaciju i prevenciju u cilju obezbeđivanja najboljeg mogućeg odnosa koristi i rizika leka u svakodnevnoj praksi i promocije racionalne i bezbedne farmakoterapije. Ove aktivnosti farmakovigilance ALIMS sprovodi preko svog Nacionalnog centra za farmakovigilancu (NCF).
Kao krucijalni element zaštite javnog zdravlja, farmakovigilanca predstavlja jedan od najvažnijih poslova ALIMS-a za sadašnji i budući period. Radeći zajedno sa svim stranama uključenim u oblast farmakovigilance, ALIMS želi da doprinese jačanju sistema farmakovigilance i regulatornog sistema lekova, njihovoj odgovornosti, autoritativnosti i poverenju, kako bi se unapredila bezbednost pacijenta.
Praćenje bezbednosti registrovanih lekova
Lek se smatra bezbednim ukoliko njegova očekivana korist prevazilazi potencijalni rizik od štetnih reakcija koji je u vezi sa njegovom primenom. Svaki lek može da izazove neželjenu reakciju. Međutim, važno je istaći da kod većine pacijenata primena leka prolazi bez ispoljavanja ozbiljnih neželjenih reakcija.
Pre nego što se lek stavi u promet (premarketinški period), sprovode se obimna istraživanja: pretklinička ispitivanja na životinjama i klinička ispitivanja na ljudima. Programi kliničkih ispitivanja prate stroga pravila i dizajnirani su kako bi se demonstrirao pozitivan odnos koristi i rizika terapijske primene leka u specifičnoj indikaciji i populaciji pacijanata.
Lek se registruje ukoliko su dokazani njegov kvalitet, efikasnost i bezbednost, što uključuje da je pokazan pozitivan odnos koristi i rizika u trenutku registracije (demonstrirana je terapijska efikasnost i rizici, u formi neželjenih reakcija, mogu se smatrati prihvatljivim u tom trenutku).
Klinička ispitivanja se sprovode pod specifičnim uslovima:
- ispitanici su homogeno odabrani specifično za tu studiju po strogim kriterijumima (pol, uzrast, etnička pripadnost, pušenje, uglavnom nemaju prateće bolesti i istovremeno ne koriste druge lekove itd),
- broj ispitanika i vreme trajanja studije su ograničeni,
- ispitanici se stalno prate tokom studije.
Na kraju kliničkog ispitivanja poznate su česte neželjene reakcije. Nakon registracije lek se stavlja u promet kada počinje da se primenjuje u rutinskoj kliničkoj praksi na velikom broju pacijenata. Tada još uvek ne poznajemo ukupan bezbednosni profil leka, odnosno informacije su nepotpune ili nisu uopšte dostupne u vezi sa retkim neželjenim reakcijama i reakcijama nakon dugotrajne izloženosti, interakcijama, rezistencijom, potencijalom za medicinskim greškama, neodobrenom primenom leka, zloupotrebom i pogrešnom upotrebom, primenom leka kod specifičnih kategorija pacijenata (deca, stari, trudnice, dojilje, pacijenti sa pratećim bolestima: insuficijencija jetre, bubrega, srca itd).
Iz navedenih razloga znanje o bezbednosnom profilu leka je ograničeno i mora se proširiti. Zato je od velikog značaja praćenje bezbednosti svih lekova od trenutka njihovog stavljanja u promet.
Farmakovigilanca je proces:
- praćenja upotrebe leka u svakodnevnoj praksi kako bi se identifikovale ranije neprepoznate, neočekivane neželjene reakcije ili izmene u karakteru (priroda, ozbiljnost, učestalost) ispoljavanja neželjenih reakcija,
- procene rizika i koristi lekova kako bi se utvrdilo koje mere treba sprovesti, ukoliko su potrebne, u cilju poboljšanja bezbedne primene leka,
- pružanje informacija zdravstvenim radnicima i pacijentima u cilju ostvarivanja bezbedne i efikasne primene lekova,
- praćenje uticaja i rezultata preduzetih mera.
Izvori informacija koje se koriste u farmakovigilanci:
- spontano prijavljivanje neželjenih reakcija na lekove od strane zdravstvenih radnika i pacijenata,
- kliničke i epidemiološke studije,
- medicinska literatura,
- informacije od farmaceutske industrije,
- informacije od drugih regulatornih tela sveta,
- registri (mortalitet, morbiditet, trudnice i sl).
Informacije iz navedenih izvora se detaljno pregledaju i analiziraju i mogu ukazati na novu neželjenu reakciju, koja do tada nije bila poznata za određeni lek, zatim da se neke od neželjenih reakcija pojavljuju češće nego što se dotadašnjim ispitivanjima pokazalo, da se kod određene populacije pacijenata češće ispoljavaju neželjene reakcije, otkrivaju se interakcije, moguće medicinske greške, pogrešna upotreba, zloupotreba itd.
Regulatorne mere iz bezbednosnih razloga:
Kada je potrebno, nakon procene evidentiranih podataka i identifikovaja novih bezbednosnih saznanja, ALIMS sprovodi mere kako bi se osiguralo da se lek upotrebljava na način kojim se minimizira rizik i pospešuje korist. Te mere najčešće uključuju izmene bezbednosnih informacija u Sažetku karakteristika leka i Uputstvu za lek, kao osnovnim dokumentima o leku:
- u smislu dodavanja novih važnih upozorenja i mera opreza i neželjenih reakcija,
- nove kontraindikacije (npr. ne primenjuje se kod trudnica, dece ili kod odeđenih medicinskih stanja itd),
- smanjenje preporučene doze,
- ograničenja u primeni leka (kao terapija drugog izbora, isključivanje određene bolesti ili grupe pacijenata gde se lek primenjuje, izmenu na restriktivniji režim izdavanja leka, npr. sa BR na R itd).
Sprovode se i druge regulatorne mere u cilju upravljanja rizikom, pre svega u smislu njegove minimizacije, a u retkim slučajevima sprovodi se prestanak važenja dozvole za lek ili njeno privremeno stavljanje van snage iz bezbednosnih razloga i povlačenje leka iz prometa, kada se pokaže da potencijalni rizik nadmašuje očekivanu korist pri uobičajenoj terapijskoj primeni leka.
Mnoge virusne vakcine koje su u upotrebi koriste žive viruse. Kad se unesu u pacijenta, uspostavljaju prigušenu infekciju koja se širi među ćelijama domaćina, sa namerom da infekcija bude dovoljna da izazove imunitet, ali ne da izazove bolest.
Budući da su žive, ove vakcine su u principu sposobne da izazovu prenos unetog oslabljenog virusa sa vakcinisane osobe na nove domaćine sa kojima vakcinisana osoba dođe u kontakt.
[ 1 ] [ 2 ] [ 3 ] [ 4 ] [ 5 ] [ 6 ] [ 7 ] [ 8 ] [ 9 ] [ 10 ] [ 11 ] [ 12 ] [ 13]
Virusi iz vakcine mogu biti izlučeni od strane vakcinisane osobe i doći u kontakt sa drugim osobama, uključujući trudnice i žene koje doje. Ipak, bezbednosni profil oralne vakcine protiv poliomijelitisa, tip 1 i 3 kod trudnica i žena koje doje nije poznat. Izlučivanje virusa koji su sadržani u vakcini može da dovede do indirektne vakcinacije osobe koja je u kontaktu sa izlučevinom. To naročito opravdava upotrebu oralne vakcine protiv poliomijelitisa tokom epidemije. Osim kod izuzetnih slučajeva kod bolesnika sa poremećajem imuniteta, usled fenomena reverzije vakcinalnih sojeva paralitički polio može se pojaviti izuzetno retko, i kod već vakcinisanog pacijenta ili kod pacijenata u bliskom kontaktu (videti 4.8 Neželjena dejstva). Izuzetno, fenomen reverzije vakcinisanih virusa može kod vakcinisanih osoba i osoba koje su u bliskom kontaktu sa njima, da dovede do paralize poznate kao Paralitički poliomijelitis povezan sa vakcinom (videti odeljak 4.8).
Kod većine osetljivih osoba, 7 do 28 dana posle vakcinacije zabeleženo je izlučivanje malih količina živog atenuisanog virusa rubele iz nosa ili grla. Ne postoje potvrđeni dokazi koji bi ukazali da se virus na taj način preneo na osetljive osobe koje su bile u kontaktu sa vakcinisanom osobom. Isto tako, prenošenje virusa putem bliskog ličnog kontakta, iako postoji kao teorijska mogućnost, ne smatra se značajnim rizikom. Međutim, zabeleženo je prenošenje virusa rubele iz vakcine na odojčad preko majčinog mleka, ali pri tome nije bilo znakova kliničke bolesti (videti odeljak 4.6). Nisu prijavljeni slučajevi prenošenja jače atenuisanog soja virusa malih boginja Enders’ Edmonston ili soja virusa zauški Jeryl Lynn™ iz vakcine sa vakcinisanih osoba na osetljive osobe.
Nije dokumentovana transmisija virusa morbila i parotitisa sa vakcinisanih na osetljive osobe. Poznato je da se faringealna ekskrecija virusa rubele javlja u periodu između 7 do 28 dana nakon vakcinacije, sa maksimumom ekskrecije oko 11. dana. Međutim, nije dokazana transmisija izlučenog virusa sa vakcinisanih na osetljive osobe. Dokumentovano je prenošenje vakcinalnog virusa rubele kod odojčadi preko majčinog mleka ili tranplacentalna transmisija, ali bez dokaza o kliničkoj bolesti.
Poznato je da se izlučivanje virusa poreklom iz vakcine nakon vakcinacije vrši putem stolice sa maksimumom izlučivanja oko 7. dana od primene. Antigene čestice virusa detektovane ELISA testom pronađene su u 50% uzoraka stolice nakon primene prve doze vakcine Rotarix u liofilizovanoj formulaciji i u 4% uzoraka stolice nakon primene druge doze. Kada su navedene stolice testirane na prisustvo živog vakcinalnog soja virusa, samo 17% uzoraka stolice je bilo pozitivno. U dva uporedna kontrolisana ispitivanja, poređeno je izlučivanje virusa nakon primene vakcine Rotarix u tečnoj formulaciji u odnosu na izlučivanje zabeleženo nakon primene vakcine Rotarix u liofilizovanoj formulaciji. Primećeni su slučajevi transmisije izlučenog virusa poreklom iz vakcine na seronegativne osobe koje su u kontaktu sa vakcinisanim osobama, bez pojave bilo kojih kliničkih simptoma. Vakcinu Rotarix treba sa oprezom primeniti kod odojčadi koja su u bliskom kontaktu sa imunodeficijentnim osobama, kao što su osobe sa malignitetima, osobe koje su imunokompromitovane na drugi način ili osobe koje primaju imunosupresivnu terapiju. Osobe koje su u kontaktu sa nedavno vakcinisanim odojčetom treba posebno da vode računa o ličnoj higijeni (npr. pranje ruku nakon menjanja bebinih pelena).
U kliničkim ispitivanjima uočeno je da je vakcina RotaTeq izlučena fecesom kod 8,9% vakcinisanih, a to se skoro u svim slučajevima dogodilo u nedelji nakon primanja prve doze, a samo kod jednog vakcinisanog (0,3%) ovo je uočeno nakon primanja treće doze. Maksimalno izlučivanje uočeno je u prvih 7 dana nakon doziranja. U postmarketinškom periodu zabeležen je prenos sojeva virusa iz vakcine na nevakcinisane osobe sa kojima je odojče bilo u kontaktu. Vakcinu RotaTeq treba oprezno davati odojčadi koja su u bliskom kontaktu sa imunodeficijentnim osobama (na primer sa osobama koje boluju od malignih bolesti, ili imaju na neki drugi način oslabljen imunski sistem, ili sa osobama koje primaju imunosupresivnu terapiju). Takođe, osobe koje se brinu o nedavno vakcinisanom odojčetu treba da sprovode stroge higijenske mere, a posebno kada su u kontaktu i rukuju sa izlučevinama odojčeta.
Pokazano je da se transmisija Oka vakcinalnog virusa dešava u veoma malom procentu kod seronegativnih kontakata vakcinisanih osoba sa osipom. Ne može se isključiti transmisija Oka vakcinalnog virusa kontaktom sa vakcinisanom osobom koja nije razvila osip na seronegativne kontakte. Trebalo bi izbegavati svaki kontakt sa trudnicama osetljivim na virus varičele (posebno tokom prvog trimestra trudnoće) i sa osobama pod visokim rizikom od razvoja teškog oblika varičele (kao što su pacijenti 4 od 13 sa leukemijom ili pacijenti koji primaju imunosupresivnu terapiju), posebno kada se kod vakcinisane osobe razvije osip 2 do 3 nedelje nakon imunizacije. U slučaju da se kontakt sa navedenim populacijama ne može izbeći, mora se proceniti potencijalni rizik od transmisije vakcinalnog virusa nasuprot riziku od dobijanja i transmisije prirodnog virusa varičele. Vakcinisane osobe, kod kojih se pojavi osip u toku 3 nedelje posle vakcinacije moraju izbegavati svaki kontakt sa ženama u drugom stanju (posebno u toku prva tri meseca trudnoće). Pokazana je transmisija vakcinalnog virusa između imunosuprimovanih rođaka, ali su kožne manifestacije bile veoma blage kod inficiranog deteta.
Izražava se kao proporcija imunih u kolektivu.
Stepen kolektivnog imuniteta potreban da bi se sprečila bolest zavisi od dužine zaraznosti pojedinca, sposobnosti da prenese zarazu, vrste i načina prenošenja agensa, gustine kolektiva i intenziteta kontakata.
Postojanjem kolektivnog imuniteta mogu se objasniti: izostanak epidemije, ciklične varijacije i samoregulacija epidemije.
Žutica je jedno od najčešćih stanja koje zahteva medicinsku pažnju kod novorođenčadi.
Žutica se manifestuje žutom bojom kože i beonjača i uzrokovana je povećanim nivoom bilirubina u cirkulaciji, stanje poznato kao hiperbilirubinemija.
Oko 60% terminskih i 80% preterminskih beba razvije žuticu u prvoj nedelji života, a kod oko 10% beba koje sisaju, žutica traje do prvog meseca.
Za većinu beba, rana žutica je bezopasna.
Ponekad, neke bebe mogu razviti veoma visok nivo bilirubina, koji može biti štetan ako se ne leči.
Dijagnostika i sama procena žutice mogu biti problematični, posebno kod beba sa tamnijom bojom kože.
Jednom, kada se dijagnostifikuje žutica, postavlja se pitanje tajminga odnosno vremena lečenja, a postoji takođe široko rasprostranjeno oprečno mišljenje po pitanju primjene fototerapije i eksangvinotransfuzije.
Prilikom lečenja i nege treba voditi računa o željama roditelja. Dobra komunikacija je veoma bitna.
Trebala bi biti potkrepljena informacijama zasnovanim na dokazima i da omogući roditeljima da donesu informisane odluke o zdravstvenoj zaštiti svoje bebe.
U Srbiji, bebe odmah na rođenju dobiju vitamin K ( Konakion® MM ) i vakcinu protiv hepatitisa B ( Euvax B® ).
Ako pogledamo neželjene reakcije kod vitamina K videćemo:
- žutica
- hiperbilirubinemija
- povišene vrednosti GOT (Glutamic-oxaloacetic transaminase) i GGT (Gamma-glutamyl transpeptidase)
- bol u stomaku
- konstipacija
- meke stolice
- slabost
- agitirnost
- kožne ospe
Uzrok ovih pojava se ne može odrediti. Većina ovih neželjenjih efekata nije smatrana ozbiljnim i rešeni su bez ikakvog lečenja. Parenteralno davanje prevremeno rođenim bebama telesne mase manje od 2,5 kg može da poveća rizik za razvoj kernikterusa (bilirubinske encefalopatije).
Ako pogledamo neželjene reakcije kod vakcine protiv hepatitisa B videćemo (izdvojeno između ostalog):
- Povremeno: neonatalna žutica
- Poremećaji jetre i bilijarnog sistema : povišeni enzimi jetre i poremećaj funkcije jetre.
Razumno pitanje glasi: U kojem udelu vitamin K i vakcina protiv hepatitisa B učestvuju u razvoju žutice kod novorođenčadi?
Dr Jovana Stojković, je 12.04.2018. godine podnela zahtev za dobijanje informacije od javnog značaja Agenciji za lekove i medicinska sredstva Srbije (ALIMS) , u kome su bila postavljena dva zahteva:
- Da se dostave kopije dokumenata, odnosno informacije, o kliničkim studijama i pratećoj dokumentaciji na osnovu kojih je odobrena vakcina Priorix® u Republici Srbiji
- Da se dostave kopije dokumenata, odnosno informacije, o kliničkim studijama i pratećoj dokumentaciji na osnovu koje su odobrene ostale vakcine iz programa obavezne vakcinacije.
Dana 24.04.2018. ALIMS donosi rešenje koje potpisuje Pavle Zelić , a kojim se gornji zahtev ODBIJA, uz obrazloženje da „prema članu 207, stav 3. Zakona o lekovima i medicinskim sredstvima, RADI SUZBIJANjA NELOJALNE KONKURENCIJE, zaposleni u Agenciji NE SMEJU da otkrivaju informacije iz dokumentacije koja je podneta u postupku izdavanja dozvole za lek.“ U rešenju se dalje navodi da je tumačenje Ministarstva zdravlja pomenutog člana zakona , po kome su tražene informacije SLUŽBENA TAJNA i da ne postoji pravni osnov da agencija podatke učini dostupnim trećim licima.
Protiv ovog Rešenja, dr Jovana Stojković je podnela žalbu Povereniku za informacije od javnog značaja i zaštitu podataka o ličnosti, koji je 17.04.2019. godine doneo Rešenje o PONIŠTAVANjU rešenja ALIMS-a i vraćanju predmeta na ponovni postupak, uz konstataciju da javnost ima pravo da zna informacije u vezi ispitivanja bezbednosti vakcina.
Dana 03.05.2019. ALIMS donosi rešenje gotovo identično sa prethodnim, bez ikakvog osvrta na primedbe Poverenika, pozivajući se ponovo na „službenu tajnu“ zbog čijeg bi „odavanja“ nastupile „teške pravne posledice“ po Agenciju.




>>> Slična situacija zabeležena je i u Republici Hrvatskoj <<<