COMIRNATY® – Pfizerova vakcina protiv virusa SARS–CoV–2
Evropska agencija za lekove (EMA) je preporučila davanje uslovnog odobrenja za stavljanje u promet vakcine COMIRNATY®, koju su razvili BioNTech i Pfizer, radi sprečavanja bolesti COVID-19 kod osoba starijih od 16 godina.
▼ Ovaj je lijek pod dodatnim praćenjem. Time se omogućuje brzo otkrivanje novih sigurnosnih
informacija. Od zdravstvenih radnika se traži da prijave svaku sumnju na nuspojavu za ovaj lijek. Za
postupak prijavljivanja nuspojava vidjeti dio 4.8.
1. NAZIV LIJEKA
Comirnaty koncentrat za disperziju za injekciju
cjepivo protiv COVID-19 (mRNA, modificiranih nukleozida)
2. KVALITATIVNI I KVANTITATIVNI SASTAV
Ovo je višedozna bočica čiji se sadržaj prije primjene mora razrijediti.
Nakon razrjeđivanja, jedna bočica (0,45 ml) sadrži 5 doza od 0,3 ml.
Jedna doza (0,3 ml) sadrži 30 mikrograma mRNA cjepiva (u lipidnim nanočesticama) protiv bolesti
COVID-19.
Jednolančana glasnička RNA (mRNA) s kapom na 5’-kraju, koja kodira protein šiljka (S, engl. spike)
virusa SARS-CoV-2, dobivena pomoću in vitro transkripcije iz odgovarajućih predložaka DNA, bez
korištenja stanica.
Za cjeloviti popis pomoćnih tvari vidjeti dio 6.1.
3. FARMACEUTSKI OBLIK
Koncentrat za disperziju za injekciju (sterilni koncentrat).
Cjepivo je bijela do gotovo bijela zamrznuta disperzija (pH: 6,9 – 7,9).
4. KLINIČKI PODACI
4.1 Terapijske indikacije
Comirnaty je indiciran u osoba u dobi od 16 godina i starijih za aktivnu imunizaciju radi sprječavanja
bolesti COVID-19 prouzročene virusom SARS-CoV-2.
Ovo cjepivo mora se primjenjivati u skladu sa službenim preporukama.
4.2 Doziranje i način primjene
Doziranje
Osobe u dobi od 16 godina i starije
Comirnaty se, nakon razrjeđivanja, primjenjuje intramuskularno u 2 doze (svaka od 0,3 ml) u razmaku
od najmanje 21 dana (vidjeti dijelove 4.4 i 5.1).
Nema dostupnih podataka o međusobnoj zamjenjivosti cjepiva Comirnaty s drugim cjepivima protiv
bolesti COVID-19 za dovršenje cijepljenja. Osobe koje su primile 1 dozu cjepiva Comirnaty moraju
primiti i drugu dozu cjepiva Comirnaty kako bi dovršile cijepljenje.
Pedijatrijska populacija
Sigurnost i djelotvornost cjepiva Comirnaty u djece i adolescenata mlađih od 16 godina nisu još
ustanovljene. Dostupni su ograničeni podaci.
Starija populacija
Nije potrebna prilagodba doze u starijih osoba u dobi od ≥ 65 godina.
Način primjene
Comirnaty se mora primijeniti intramuskularno. Najbolje mjesto je deltoidni mišić nadlaktice.
Nemojte ubrizgati cjepivo intravaskularno, supkutano ili intradermalno.
Cjepivo se ne smije miješati u istoj štrcaljki s drugim cjepivima ili lijekovima.
Za mjere opreza koje treba poduzeti prije primjene cjepiva vidjeti dio 4.4.
Za upute o otapanju, rukovanju i zbrinjavanju cjepiva vidjeti dio 6.6.
4.3 Kontraindikacije
Preosjetljivost na djelatnu tvar ili neku od pomoćnih tvari navedenih u dijelu 6.1
4.4 Posebna upozorenja i mjere opreza pri uporabi
Sljedivost
Kako bi se poboljšala sljedivost bioloških lijekova, naziv i broj serije primijenjenog lijeka potrebno je jasno evidentirati.
Opće preporuke
Preosjetljivost i anafilaksija
Zabilježeni su slučajevi anafilaksije. Potrebno je uvijek osigurati promptnu dostupnost odgovarajućeg medicinskog liječenja i nadzora cijepljene osobe u slučaju da nakon primjene cjepiva nastane anafilaktička reakcija.
Preporučuje se pažljivo promatranje najmanje 15 minuta nakon cijepljenja. Drugu dozu cjepiva ne smije se dati onima koji su imali anafilaktičku reakciju na prvu dozu cjepiva Comirnaty.
Reakcije povezane s anksioznošću
Prilikom cijepljenja mogu nastati reakcije povezane s anksioznošću, uključujući i vazovagalne reakcije (sinkopa), hiperventilaciju ili stresne reakcije, kao psihogeni odgovor na primanje injekcije. Važno je poduzeti mjere opreza kako bi se izbjegla ozljeda zbog nesvjestice.
Istodobno prisutne bolesti
Cijepljenje treba odgoditi u osoba koje boluju od akutne, teške febrilne bolesti ili akutne infekcije. Cijepljenje ne treba odgoditi ako je prisutna manja infekcija i/ili malo povišena tjelesna temperatura.
Trombocitopenija i poremećaji zgrušavanja krvi
Kao i kod drugih intramuskularnih injekcija, cjepivo treba primjenjivati s oprezom osobama koje primaju antikoagulantnu terapiju ili onima s trombocitopenijom ili nekim poremećajem zgrušavanja krvi (kao što je hemofilija), zato što nakon primjene intramuskularne injekcije u tih osoba može doći do krvarenja ili nastanka modrica.
Imunokompromitirane osobe
Djelotvornost, sigurnost i imunogenost ovog cjepiva nisu procijenjene u imunokompromitiranih osoba, uključujući one koje primaju imunosupresivnu terapiju. Djelotvornost cjepiva Comirnaty može biti manja u imunosuprimiranih osoba.
Trajanje zaštite
Trajanje zaštite stečene ovim cjepivom nije poznato i još se utvrđuje u kliničkim ispitivanjima koja su u tijeku.
Ograničenja učinkovitosti cjepiva
Kao i druga cjepiva, i cjepivo Comirnaty možda neće pružiti zaštitu svim cijepljenim osobama. Pojedinci možda neće biti potpuno zaštićeni dok ne protekne 7 dana od druge doze cjepiva.
Pomoćne tvari
Ovo cjepivo sadrži manje od 1 mmol (39 mg) kalija po dozi, tj. zanemarive količine kalija.
Ovo cjepivo sadrži manje od 1 mmol (23 mg) natrija po dozi, tj. zanemarive količine natrija.
4.5 Interakcije s drugim lijekovima i drugi oblici interakcija
Nisu provedena ispitivanja interakcija.
Istodobna primjena cjepiva Comirnaty s drugim cjepivima nije ispitana.
4.6 Plodnost, trudnoća i dojenje
Trudnoća
Iskustvo s primjenom cjepiva Comirnaty u trudnica je ograničeno. Ispitivanja na životinjama ne upućuju na izravan ili neizravan štetan učinak na trudnoću, embriofetalni razvoj, porođaj ili postnatalni razvoj (vidjeti dio 5.3). Primjenu cjepiva Comirnaty tijekom trudnoće treba razmotriti samo kad su moguće koristi veće od bilo kojih potencijalnih rizika za majku i dijete.
Dojenje
Nije poznato izlučuje li se cjepivo Comirnaty u majčino mlijeko.
Plodnost
Ispitivanja na životinjama ne ukazuju na izravan ili neizravan štetan učinak na reprodukciju (vidjeti dio 5.3).
4.7 Utjecaj na sposobnost upravljanja vozilima i rada sa strojevima
Comirnaty ne utječe ili zanemarivo utječe na sposobnost upravljanja vozilima i rada sa strojevima. Međutim, neki učinci navedeni u dijelu 4.8 mogu privremeno utjecati na sposobnost upravljanja vozilima i rada sa strojevima.
4.8 Nuspojave
Sažetak sigurnosnog profila
Sigurnost primjene cjepiva Comirnaty ocijenjena je u ispitanika u dobi od 16 godina i starijih u 2 klinička ispitivanja koja su uključila 21 744 ispitanika koji su primili najmanje jednu dozu cjepiva Comirnaty.
U ispitivanju 2, ukupno je 21 720 ispitanika u dobi od 16 godina ili starijih primilo najmanje 1 dozu cjepiva Comirnaty, a ukupno 21 728 ispitanika u dobi od 16 godina ili starijih primilo je placebo (uključujući 138 adolescenata u dobi od 16 i 17 godina u skupini koja je primila cjepivo i 145 adolescenata te dobi u skupini koja je primila placebo). Ukupno je 20 519 ispitanika u dobi od 16 godina ili starijih primilo 2 doze cjepiva Comirnaty.
U vrijeme analize ispitivanja 2, sigurnost primjene ocijenjena je tijekom najmanje 2 mjeseca nakon druge doze cjepiva Comirnaty u ukupno 19 067 ispitanika (9531 koji je primio Comirnaty i 9536 koji su primili placebo) u dobi od 16 godina ili starijih. Među njima je bilo ukupno 10 727 ispitanika (5350 koji su primili Comirnaty i 5377 koji su primili placebo) u dobi od 16 do 55 godina i ukupno 8340 ispitanika (4181 koji su primili Comirnaty i 4159 koji su primili placebo) u dobi od 56 godina i starijih.
U kliničkim studijama, neželjene reakcije kod učesnika starosti 16 godina i više uključivale su bol na mjestu injekcije (84,1%), umor (62,9%), glavobolju (55,1%), bol u mišićima (38,3%), drhtavicu (31,9%), bolove u zglobovima (23,6%), groznicu (14,2%), otok na mjestu ubrizgavanja (10,5%), crvenilo na mjestu uboda (9,5%), mučninu (1,1%), malaksalost (0,5%) i limfadenopatiju (0,3%).
Obično su bile blagog ili umerenog intenziteta i povukle su se u roku od nekoliko dana nakon cjepljenja.
Nešto manja učestalost reaktogenosti bila je povezana sa većom starošću.
Tablični prikaz nuspojava u kliničkim ispitivanjima
Nuspojave opažene tijekom kliničkih ispitivanja navedene su u daljnjem tekstu prema sljedećim kategorijama učestalosti:
vrlo često (≥ 1/10)
često (≥ 1/100 i < 1/10)
manje često (≥ 1/1000 i < 1/100)
rijetko (≥ 1/10 000 i <1/1000)
vrlo rijetko (<1/10 000)
nepoznato (ne može se procijeniti iz dostupnih podataka).
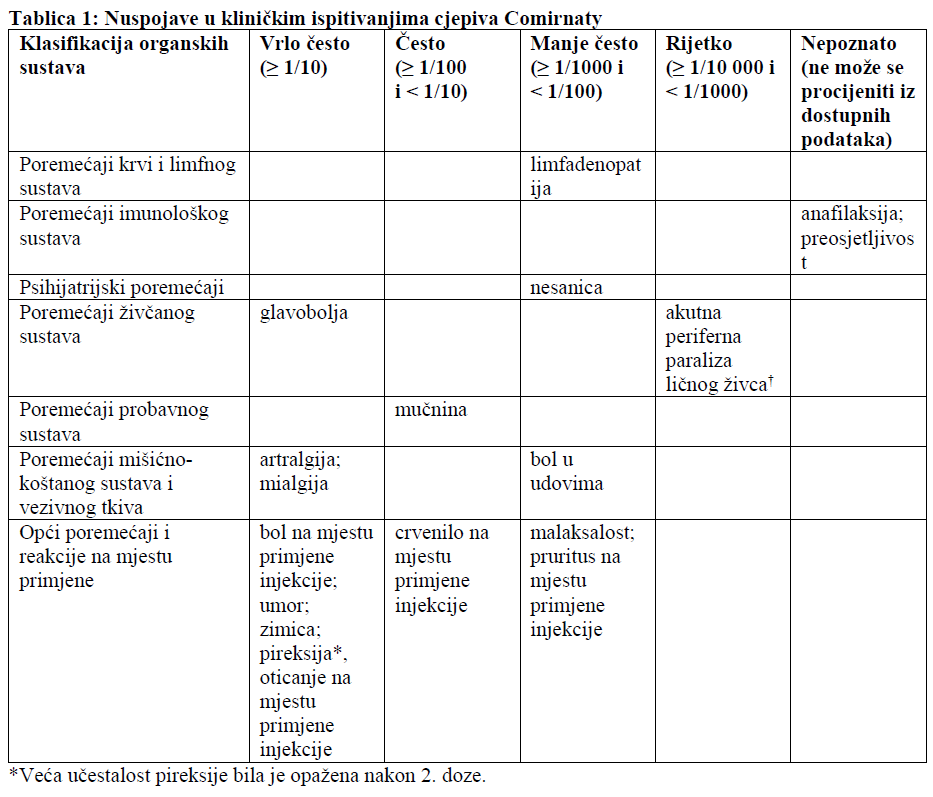
†U cijelom razdoblju praćenja sigurnosti primjene do danas, akutna periferna paraliza (ili pareza) ličnog živca zabilježena je u četiri ispitanika u skupini koja je primila mRNA cjepivo protiv bolesti COVID-19. Nastupila je 37. dana nakon 1. doze (ispitanik nije primio 2. dozu) te 3., 9. i 48. dana nakon 2. doze. U skupini koja je primila placebo nije bilo zabilježenih slučajeva akutne periferne paralize (ili pareze) ličnog živca.
Sigurnosni profil u 545 ispitanika koji su primili Comirnaty, a bili su seropozitivni na SARS-CoV-2 na početku ispitivanja bio je sličan onome opaženom u općoj populaciji.
Prijavljivanje sumnji na nuspojavu
Nakon dobivanja odobrenja lijeka važno je prijavljivanje sumnji na njegove nuspojave. Time se omogućuje kontinuirano praćenje omjera koristi i rizika lijeka. Od zdravstvenih radnika se traži da prijave svaku sumnju na nuspojavu lijeka putem nacionalnog sustava prijave nuspojava: navedenog u Dodatku V i navedu broj serije/Lot ako je dostupan.
4.9 Predoziranje
Dostupni su podaci o predoziranju u 52 ispitanika uključena u kliničko ispitivanje koja su zbog pogreške u razrjeđivanju primila 58 mikrograma cjepiva Comirnaty. Cijepljeni ispitanici nisu prijavili povećanje reaktogenosti ili nuspojava.
U slučaju predoziranja, preporučuje se praćenje vitalnih funkcija i eventualno simptomatsko liječenje.
5. FARMAKOLOŠKA SVOJSTVA
5.1 Farmakodinamička svojstva
Farmakoterapijska skupina: cjepiva, ATK oznaka: J07BX
Mehanizam djelovanja
Glasnička RNA modificiranih nukleozida u cjepivu Comirnaty formulirana je u lipidnim nanočesticama koje omogućuju ulazak nereplicirajuće RNA u stanice domaćina što dovodi do prolazne ekspresije antigena S virusa SARS-CoV-2. Ova mRNA kodira protein S pune duljine, usidren u virusnu membranu, s dvije točkaste mutacije unutar središnje uzvojnice. Mutacija ove dvije aminokiseline u prolin drži protein S u antigenski poželjnoj prefuzijskoj konformaciji. Cjepivo potiče imunosni odgovor i u obliku neutralizirajućih protutijela i u obliku staničnog imunosnog odgovora na antigen šiljka, S (engl. spike), što može pridonijeti zaštiti od bolesti COVID-19.
Djelotvornost
Ispitivanje 2 je multicentrično, multinacionalno, randomizirano, placebom kontrolirano ispitivanje faze 1/2/3 sa zaslijepljenim promatračima, za određivanje doze, odabir kandidata za cijepljenje i utvrđivanja djelotvornosti u ispitanika u dobi od 12 i više godina. Randomizacija je bila stratificirana prema dobi: od 12 do 15 godina, od 16 do 55 godina i od 56 godina naviše, s time da je najmanje 40% ispitanika bilo u stratumu od ≥ 56 godina. Iz ispitivanja su isključene imunokompromitirane osobe i one koje su prethodno imale kliničku ili mikrobiološku dijagnozu bolesti COVID-19. Uključeni su bili ispitanici s već prisutnom stabilnom bolešću, definiranom kao bolest koja ne zahtijeva značajnu promjenu terapije ili hospitalizaciju zbog pogoršanja bolesti tijekom 6 tjedana prije uključenja u ispitivanje, kao i ispitanici s poznatom stabilnom infekcijom virusom humane imunodeficijencije (HIV), virusom hepatitisa C (HCV) ili virusom hepatitisa B (HBV). U vrijeme analize ispitivanja 2, navedene informacije temelje se na podacima ispitanika u dobi od 16 godina ili starijih.
Djelotvornost u ispitanika u dobi od 16 godina ili starijih
U dijelu faze 2/3, približno 44 000 ispitanika bilo je podjednako randomizirano kako bi primilo 2 doze mRNA cjepiva protiv bolesti COVID-19 ili placeba u razmaku od 21 dana. Analize djelotvornosti uključile su ispitanike koji su primili drugu dozu cjepiva unutar 19 do 42 dana nakon prve doze cjepiva. Ispitanike je planirano pratiti do 24 mjeseca nakon druge doze radi ocjene sigurnosti i djelotvornosti cjepiva protiv bolesti COVID-19. Da bi primili placebo ili mRNA cjepivo protiv bolesti COVID-19 u kliničkom ispitivanju, ispitanici su morali paziti da im od cijepljenja ili do cijepljenja protiv gripe protekne najmanje 14 dana. Da bi primili placebo ili mRNA cjepivo protiv bolesti COVID-19 u kliničkom ispitivanju, ispitanici su morali paziti da im od primanja ili do primanja lijekova iz ljudske krvi/plazme ili imunoglobulina protekne najmanje 60 dana u razdoblju do zaključenja ispitivanja.
Analiza primarne mjere ishoda za djelotvornost uključila je populaciju od 36 621 ispitanika u dobi od 12 i više godina (18 242 u skupini koja je primila mRNA cjepivo protiv bolesti COVID-19 i 18 379 u skupini koja je primila placebo) u kojih nije bilo dokaza prethodne infekcije virusom SARS-CoV-2 do 7. dana nakon druge doze. Nadalje, 134 ispitanika bilo je u dobi od 16 i 17 godina (66 u skupini koja je primila mRNA cjepivo protiv bolesti COVID-19 i 68 u skupini koja je primila placebo), a 1616 ispitanika bilo je u dobi od 75 godina i starije (804 u skupini koja je primila mRNA cjepivo protiv bolesti COVID-19 i 812 u skupini koja je primila placebo).
Djelotvornost protiv bolesti COVID-19
U vrijeme primarne analize djelotvornosti, ispitanici su bili praćeni radi eventualne simptomatske bolesti COVID-19 ukupno 2214 osoba-godina u skupini koja je primila mRNA cjepivo protiv bolesti COVID-19 i ukupno 2222 osoba-godina u skupini koja je primila placebo.
Nije bilo značajnih kliničkih razlika u cjelokupnoj djelotvornosti cjepiva u ispitanika u kojih je postojao rizik od teške bolesti COVID-19, uključujući ispitanike s 1 ili više komorbiditeta koji povećavaju rizik od teške bolesti COVID-19 (npr. astma, indeks tjelesne mase (ITM) ≥ 30 kg/m2, kronična plućna bolest, šećerna bolest, hipertenzija).
Podaci o djelotvornosti cjepiva prikazani su u tablici 2.

Napomena: Potvrđeni slučajevi utvrđeni su lančanom reakcijom polimerazom uz reverznu transkripciju (RT-PCR) i prisutnošću najmanje 1 simptoma koji odgovara bolesti COVID-19*. [*Definicija slučaja: (najmanje 1 od navedenog) vrućica, pojava ili pogoršanje kašlja, pojava ili pogoršanje nedostatka zraka, zimica, pojava ili pojačanje bola u mišićima, novonastali gubitak osjeta okusa ili mirisa, grlobolja, proljev ili povraćanje.]
* U analizu su bili uključeni ispitanici koji nisu imali ni serološki ni virološki dokaz (u razdoblju do 7. dana nakon primanja zadnje doze) prethodne infekcije virusom SARS-CoV-2 (tj., koji su imali negativan nalaz na protutijela koja se vezuju na N protein [serum] prilikom prvog dolaska i kojima nije otkriven SARS-CoV-2 testom amplifikacije nukleinskih kiselina (NAAT) [obrisak nosa] prilikom prvog i drugog dolaska) i imali su negativan rezultat testa NAAT (obrisak nosa) prilikom bilo kojeg nepredviđenog dolaska u razdoblju do 7. dana nakon 2. doze.
a. N = broj ispitanika u navedenoj skupini.
b. n1 = broj ispitanika u kojih je bila zadovoljena definicija mjere ishoda.
c. Ukupno vrijeme praćenja u 1000 osoba-godina za danu mjeru ishoda u svih ispitanika u pojedinoj skupini s rizikom od nastanka mjere ishoda. Razdoblje mjerenja prirasta broja slučajeva bolesti COVID-19 bilo je od 7. dana nakon 2. doze do kraja razdoblja praćenja.
d. n2 = broj ispitanika s rizikom od nastanka mjere ishoda.
e. Nije bilo potvrđenih slučajeva u ispitanika u dobi od 12 do 15 godina.
f. Interval pouzdanosti (CI) za djelotvornost cjepiva izveden je na temelju Clopperove i Pearsonove metode, prilagođeno vremenu praćenja. CI nije prilagođen na višestrukost.
U drugoj primarnoj analizi, u usporedbi s placebom, djelotvornost mRNA cjepiva protiv bolesti COVID-19 u ispitanika s prvom pojavom bolesti COVID-19 nakon 7. dana poslije 2. doze u usporedbi s ispitanicima s dokazom ili bez dokaza prethodne infekcije virusom SARS-CoV-2 iznosila je 94,6% (95%-tni vjerojatni raspon od 89,9% do 97,3) u ispitanika u dobi od 16 godina i starijih.
Nadalje, analize primarne mjere ishoda za djelotvornost po podskupinama pokazale su sličnu brojčanu procjenu djelotvornosti u oba spola, među rasnim i etničkim skupinama i ispitanicima sa zdravstvenim komorbiditetima povezanima s visokim rizikom od teškog oblika bolesti COVID-19.
Pedijatrijska populacija
Europska agencija za lijekove odgodila je obvezu podnošenja rezultata ispitivanja cjepiva Comirnaty u pedijatrijskoj populaciji u prevenciji bolesti COVID-19 (vidjeti dio 4.2 za informacije o pedijatrijskoj primjeni).
Ovaj lijek je odobren po shemi takozvanog „uvjetnog odobrenja”. To znači da se očekuju dodatni podaci o ovom lijeku. Europska agencija za lijekove će barem jednom godišnje procjenjivati nove informacije o ovom lijeku te će se tekst sažetka opisa svojstava lijeka ažurirati prema potrebi.
5.2 Farmakokinetička svojstva
Nije primjenjivo.
5.3 Neklinički podaci o sigurnosti primjene
Neklinički podaci ne ukazuju na poseban rizik za ljude na temelju konvencionalnih ispitivanja toksičnosti ponovljenih doza, reproduktivne i razvojne toksičnosti.
Opća toksičnost
Štakori kojima je intramuskularno primijenjen Comirnaty (primali 3 pune doze za ljude jednom tjedno, koje su stvarale relativno visoke razine u štakora zbog razlike u tjelesnoj težini) pokazali su nešto edema i eritema na mjestu primjene injekcije i povećanje broja bijelih krvnih stanica (uključujući bazofila i eozinofila), što je u skladu s upalnim odgovorom, kao i vakuolizaciju portalnih hepatocita bez dokaza oštećenja jetre. Svi su učinci bili reverzibilni.
Genotoksičnost/kancerogenost
Nisu provedena ispitivanja ni genotoksičnosti ni kancerogenosti. Ne očekuje se da će sastojci cjepiva (lipidi i mRNA) imati genotoksični potencijal.
Reproduktivna toksičnost
Reproduktivna i razvojna toksičnost ispitane su na štakorima u kombiniranom ispitivanju toksičnosti za plodnost i razvojne toksičnosti u kojem je ženkama štakora intramuskularno primijenjeno cjepivo Comirnaty prije parenja i tijekom gestacije (primile su 4 pune doze za ljude koje stvaraju relativno više razine u štakora zbog razlike u tjelesnoj težini, u razdoblju između 21 dana prije parenja do 20. dana gestacije). Odgovor neutralizirajućih protutijela na SARS-CoV-2 bio je prisutan u ženki od vremena prije parenja do kraja ovog ispitivanja koje je završilo 21. postnatalnog dana, kao i u fetusa i potomstva. Nije bilo učinaka povezanih s cjepivom na žensku plodnost, graviditet ili embriofetalni razvoj ili razvoj mladunčadi. Nema dostupnih podataka o prelasku cjepiva Comirnaty kroz placentu ili njegovom izlučivanju u mlijeku.
6. FARMACEUTSKI PODACI
6.1 Popis pomoćnih tvari
- ((4-hidroksibutil)azanediil)bis(heksan-6,1-diil)bis(2-heksildekanoat) (ALC-0315)
- 2-[(polietilenglikol)-2000]-N,N-ditetradecilacetamid (ALC-0159)
- 1,2-distearoil-sn-glicero-3-fosfokolin (DSPC)
- kolesterol
- kalijev klorid
- kalijev dihidrogenfosfat
- natrijev klorid
- natrijev hidrogenfosfat dihidrat
- saharoza
- voda za injekcije
6.2 Inkompatibilnosti
Lijek se ne smije miješati s drugim lijekovima osim onih navedenih u dijelu 6.6.
6.3 Rok valjanosti
Neotvorena bočica: 6 mjeseci na temperaturi od -90 °C do -60 °C.
Nakon što se izvadi iz zamrzivača, neotvorena bočica cjepiva može se prije upotrebe čuvati do 5 dana na temperaturi od 2 °C do 8 °C i do 2 sata na temperaturi do 30 °C.
Nakon otapanja, cjepivo se ne smije ponovno zamrznuti.
Poklopcem zatvoreni podlošci koji sadrže 195 bočica izvađeni iz zamrzivača (< -60°C) u kojem su se čuvali mogu biti na sobnoj temperaturi (< 25°C) do 5 minuta radi prijenosa iz jednog u drugi zamrzivač iznimno niske temperature. Kad se podlošci s bočicama vrate u zamrzivač nakon što su bili izloženi sobnoj temperaturi, moraju ostati u zamrzivaču najmanje 2 sata prije nego što se smiju ponovno izvaditi iz zamrzivača.
Razrijeđeno cjepivo
Dokazano je da je cjepivo u primjeni kemijski i fizikalno stabilno 6 sati na temperaturi od 2 ºC do 30 ºC nakon razrjeđivanja s 9%-tnom otopinom natrijeva klorida (9 mg/ml) za injekciju.
S mikrobiološkog stanovišta, cjepivo se mora odmah primijeniti. Ako se ne primijeni odmah, vrijeme i uvjeti čuvanja cjepiva u primjeni odgovornost su korisnika.
6.4 Posebne mjere pri čuvanju lijeka
Čuvati u zamrzivaču na temperaturi od -90 °C do -60 °C.
Čuvati u originalnom pakiranju radi zaštite od svjetlosti.
Tijekom čuvanja, izloženost umjetnoj rasvjeti potrebno je svesti na najmanju moguću mjeru, kao i izbjegavati izloženost izravnoj sunčevoj svjetlosti i ultraljubičastom zračenju.
Bočicama s otopljenim sadržajem smije se rukovati pri sobnoj svjetlosti.
Kad ste spremni otopiti ili primijeniti cjepivo
• Otvoreni podlošci s bočicama ili podlošci s bočicama koji sadrže manje od 195 bočica izvađeni iz zamrzivača u kojem su se čuvali (< -60 °C) mogu biti na sobnoj temperaturi (< 25 °C) do 3 minute kako bi se izvadile bočice ili podlošci prenijeli iz jednog u drugi zamrzivač iznimno niske temperature.
• Nakon što se bočica izvadi iz podloška s bočicama, mora se otopiti za primjenu.
• Kad se podlošci s bočicama vrate u zamrzivač nakon što su bili izloženi sobnoj temperaturi, moraju ostati u zamrzivaču najmanje 2 sata prije nego što se smiju ponovno izvaditi iz zamrzivača.
Uvjete čuvanja nakon otapanja i razrjeđivanja cjepiva vidjeti u dijelu 6.3.
6.5 Vrsta i sadržaj spremnika
Višedozna bočica od 2 ml od prozirnog stakla (staklo tip I), s čepom (sintetska bromobutilna guma) i plastičnim poklopcem s aluminijskim prstenom. Jedna bočica sadrži 5 doza.
Veličina pakiranja: 195 bočica
6.6 Posebne mjere za zbrinjavanje i druga rukovanja lijekom
Upute za rukovanje
Comirnaty mora pripremiti zdravstveni radnik pomoću aseptične tehnike kako bi se osigurala sterilnost pripremljene disperzije.