Torlakova vakcina protiv gripa – TorVaxFlu®
Registrovana Torlakova vakcina protiv gripa – Torlakova vakcina protiv gripa TorVaxFlu® – Šta treba znati?
TorVaxFlu® je trovalentna vakcina protiv gripa čiji je proizvođač Institut za virusologiju, vakcine i serume Torlak.
Vakcina je prvi put registrovana u ALIMS-u 14.08.2020. godine.
▼ Ovaj lek je pod dodatnim praćenjem. Time se omogućava brzo otkrivanje novih bezbednosnih
informacija. Zdravstveni radnici treba da prijave svaku sumnju na neželjene reakcije na ovaj lek. Za način
prijavljivanja neželjenih reakcija videti odeljak 4.8.
Vakcina odgovara preporuci Svetske zdravstvene organizacije za severnu hemisferu i odluci Evropske unije
za sezonu 2020/2021.
Vakcina TorVaxFlu može sadržati tragove jaja (kao što je ovalbumin), neomicina, Triton X-100 i
betapropiolaktona koji se koriste tokom proizvodnog procesa (videti odeljak 4.3).
Vakcina TorVaxFlu ne sadrži konzervans.
Kao i druge vakcine i vakcina TorVaxFlu ne štiti sve osobe koje su vakcinisane.
Vakcina TorVaxFlu obezbeđuje zaštitu od onih sojeva virusa gripa od kojih je vakcina i napravljena.
Nivo antitela kod pacijenata sa kongenitalnom ili stečenom imunosupresijom može biti nedovoljan.
Studije interakcije vakcine TorVaxFlu sa drugim lekovima nisu rađene.
Vakcina TorVaxFlu nije klinički ispitivana za primenu kod trudnica i dojilja.
Vakcinom TorVaxFlu se obezbeđuje imunizacija protiv tri soja virusa gripa (dva podtipa soja A, jedan tip
soja B) koji se nalaze u vakcini. Seroprotekcija se obično postiže u roku od 3 nedelje nakon vakcinacije.
Godišnja revakcinacija vakcinom TorVaxFlu nije proučavana. Međutim, na osnovu preporuka za druge
vakcine protiv gripa i činjenice da se sojevi koji ulaze u sastav vakcina godišnje revidiraju od strane SZO,
preporučuje se strategija vakcinacije protiv gripa svake godine.
Bezbednost i imunogenost vakcine TorVaxFlu procenjene su u okviru dva dvostruko slepa, randomizovana,
placebo kontrolisana klinička ispitivanja na zdravim dobrovoljcima od 18-45 godina života (Torlak-100) i
dobrovoljcima od 18-65 godina života (Torlak-300).
Vakcina TorVaxFlu je indikovana za prevenciju gripa kod odraslih od 18 do 65 godina života.
Bezbednost i efikasnost kod dece i adolescenata uzrasta do 18 godina nisu još ustanovljene.
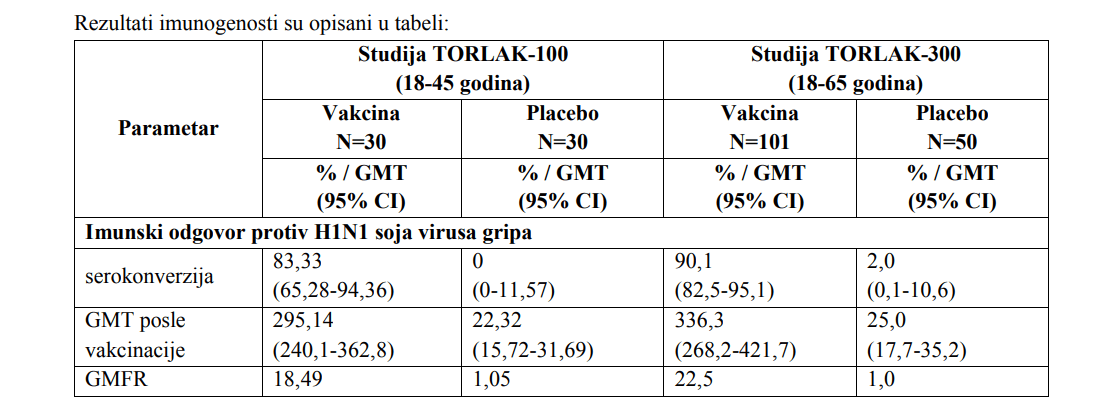
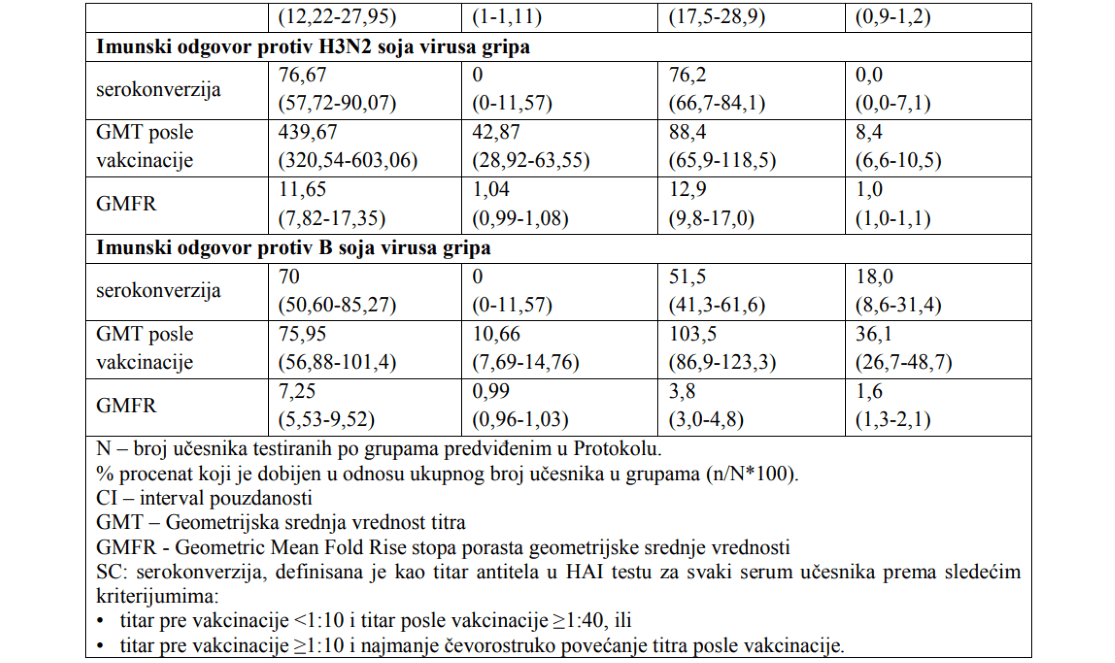
– Imunogenost vakcine TorVaxFlu kod odraslih od 18 do 65 godina života
- Imunogenost vakcine je proučavana u okviru populacije koja je bila uključena u dve opisane studije.
U kliničkim ispitivanjima Torlak-100 i Torlak-300, najčešće prijavljivane neželjene reakcije su očekivane
(lokalne i sistemske). Neočekivane neželjene reakcije su bile retke, a ozbiljnih neočekivanih neželjenih
reakcija nije bilo. Najveći broj očekivanih reakcija su bile blage po intenzitetu, a prijavljeno je samo
nekoliko umerenog intenziteta.
Kod četiri ispitanika u grupi koja je primila vakcinu zabeležene su ozbiljne očekivane sistemske neželjene reakcije.
4.3 Kontraindikacije
Preosetljivost na aktivne supstance, ili na bilo koju od pomoćnih supstanci navedenih u odeljku 6.1 ili na
neku supstancu koja može biti prisutna u tragovima kao što su proteini jaja (ovalbumin, kokošiji protein),
neomicin, Triton X-100 i betapropiolakton.
Vakcinaciju je potrebno odložiti u slučaju akutne infekcije ili u slučaju bolesti praćene povišenom telesnom
temperaturom.
Nakon primene vakcine, kao i kod drugih lekova koji se primenjuju injekcionim putem, moguća je pojava
anafilaktičke reakcije. Zdravstvena ustanova u kojoj se sprovodi vakcinacija mora omogućiti pružanje
odgovarajućeg medicinskog lečenja u slučaju ispoljavanja anafilaktičkog šoka. Sve vakcinisane osobe treba
da budu pod nadzorom lekara najmanje 30 minuta nakon primene vakcine.
Kao i sve ostale vakcine koje se primenjuju intramuskularno, vakcinu TorVaxFlu treba sa oprezom primeniti
osobama sa trombocitopenijom ili poremećajem koagulacije, jer prilikom intramuskularne primene može
doći do krvarenja kod ovih osoba.
Sinkopa (nagli gubitak svesti) može se pojaviti pre ili tokom vakcinacije kao psihološki odgovor na
injekcionu iglu. Potrebno je sprovoditi procedure za sprečavanje povreda uzrokovanih naglim gubitkom
svesti, kao i za tretiranje sinkope.
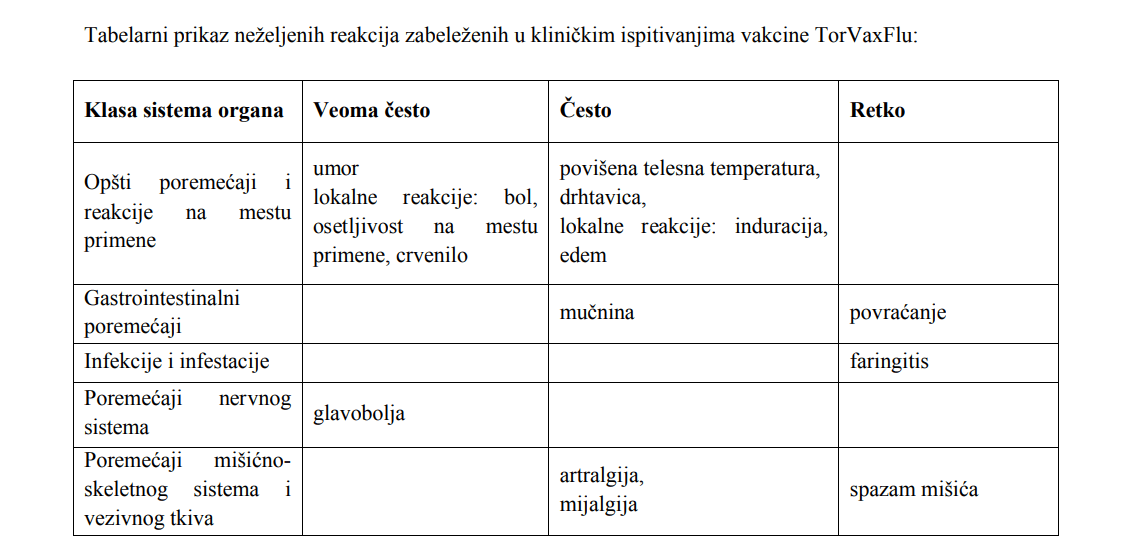
4.8 Neželjena dejstva
Neželjene reakcije zabeležene u kliničkim ispitivanjima vakcine TorVaxFlu
Bezbednost vakcine TorVaxFlu procenjena je u okviru dva dvostruko slepa, randomizovana, placebo
kontrolisana klinička ispitivanja: Torlak-100 i Torlak-300 (videti odeljak 5.1).
U nastavku je dat tabelarni prikaz neželjenih reakcija zabeleženih u kliničkim ispitivanjima vakcine
TorVaxFlu, razvrstanih po klasama sistema organa i učestalosti ispoljavanja.
Prema učestalosti ispoljavanja, neželjene reakcije klasifikuju se po sledećim kategorijama: veoma često (≥
1/10), često (≥1/100 do <1/10), povremeno (≥1/1000 do <1/100), retko (≥1/10000 do <1/1000), veoma retko
(<1/10000) i nepoznato (ne može se proceniti na osnovu dostupnih podataka).
Ostale moguće neželjene reakcije
Na osnovu literaturnih podataka, uključujući podatke postmarketinškog (nakon stavljanja u promet)
praćenja neželjenih reakcija na inaktivisane vakcine protiv gripa, sledeće neželjene reakcije mogu da
se dovedu u vezu sa primenom inaktivisane vakcine protiv gripa (nepoznate učestalosti):
Poremećaji krvi i limfnog sistema
- Prolazna trombocitopenija, prolazna limfadenopatija.
Poremećaji imunskog sistema
- Alergijske reakcije koje u retkim slučajevima dovode do šoka, angioedem, a u veoma retkim slučajevima
otok se može pojaviti i na drugim delovima tela.
Poremećaji nervnog sistema
- Neuralgija, parestezije, konvulzije, neurološki poremećaji, kao što su encefalomijelitis, neuritis i GuillainBarré sindrom (GBS).
Vaskularni poremećaji
- Vaskulitis koji može rezultirati osipom na koži i u veoma retkim slučajevima praćen prolaznim poremećajem
funkcije bubrega.
Poremećaji kože i potkožnog tkiva
- Generalizovane kožne reakcije, uključujući pruritus, urtikariju ili nespecifični osip.
Prijavljivanje neželjenih reakcija
Prijavljivanje sumnji na neželjene reakcije posle dobijanja dozvole za lek je važno. Time se omogućava
kontinuirano praćenje odnosa koristi i rizika leka. Zdravstveni radnici treba da prijave svaku sumnju na
neželjene reakcije na ovaj lek Agenciji za lekove i medicinska sredstva Srbije (ALIMS):
Agencija za lekove i medicinska sredstva Srbije
Nacionalni centar za farmakovigilancu
Vojvode Stepe 458, 11221 Beograd
Republika Srbija
website: www.alims.gov.rs
e-mail: nezeljene.reakcije@alims.gov.rs