Vakcina protiv gripa VaxigripTetra
Šta treba znati?
Šta treba znati?
Sanofijeva vakcina protiv gripa – VaxigripTetra vakcina protiv gripa – Šta treba znati?
- Srbija
- Za uzrast od 6-36 meseci (1 000 doza)
Vaxigrip Tetra® (SANOFI PASTEUR) - Za lica starija od 3 godine (343 920 doza)
Influvac® Tetra (ABBOTT BIOLOGICALS B.V.)
- Za uzrast od 6-36 meseci (1 000 doza)
- Crna Gora (31 000 doza)
- Vaxigrip Tetra® (SANOFI PASTEUR)
- BIH (23 500 doza)
- Vaxigrip Tetra® (SANOFI PASTEUR)
- Hrvatska (940 000 doza)
- Vaxigrip Tetra® (SANOFI PASTEUR)
Vaxigrip Tetra® je četvorovalentna split vakcina (sadrži 4 soja fragmentisanog inaktivisanog virusa) odobrena u Evropi 2016. godine za osobe starije od 3 godine, naslednica trovalentne Vaxigrip® vakcine. [1] [2] [3] [4]
“ Ovaj lek je pod dodatnim praćenjem. Time se omogućava brzo otkrivanje novih bezbednosnih
informacija. Zdravstveni radnici treba da prijave svaku sumnju na neželjene reakcije na ovaj lek. Za način
prijavljivanja neželjenih reakcija videti odeljak 4.8. ”
– Ovo je prva rečenica na koju ćete naići ako pročitate SAŽETAK KARAKTERISTIKA LEKA.
“ VaxigripTetra je indikovan za aktivnu imunizaciju odraslih i dece od 3 godine i starije, za prevenciju
influence uzrokovane sa dva podtipa influenca A virusa i dva podtipa influenca B virusa sadržana u vakcini.
Primena VaxigripTetra vakcine treba da bude zasnovana na zvaničnim nacionalnim preporukama. ”
– Poslednji datum revizije teksta je Novembar, 2018. godine.
U međuvremenu su urađene studije nad decom uzrasta od 6 meseci i starijom. [5] [6] [7]
S druge strane, sprečavanje infekcije sezonskim virusima gripa vakcinacijom može sprečiti indukciju heterosubtipskog imuniteta na sojeve pandemije, što bi mogao biti nedostatak za imunološki naivne osobe – npr. Odojčad. [8]
“ Trudnoća
Inaktivisana vakcina protiv gripa se može koristiti u svim stadijumima trudnoće. Za drugi i treći trimestar su
raspoloživi obimniji podaci o bezbednosti u odnosu na prvi trimestar; ipak, podaci o primeni inaktivisane
vakcine protiv gripa širom sveta ne ukazuju na bilo kakva štetna dejstva vakcinacije za plod ili majku.
Nema dostupnih podataka o primeni vakcine VaxigripTetra kod trudnica. ”
U međuvremenu je urađena studija. [9]
Međutim,u periodu od 2010-2016. godine prijavljivani su neželjeni događaji kod trudnica nakon primanja vakcine protiv gripa. [10]
Prijavljivani su:
- Spontani pobačaji
- Mrtvorođeno dete
- Fetalna smrt (gestacijska starost nepoznata)
- Prevremeni porođaj
- Preeklampsija / hipertenzija izazvana trudnoćom
- Vaginalno krvarenje
- Poremećaji imunološkog sistema
- Anafilaksija
- Ne-anafilaksične alergijske reakcije
- Respiratorni, torakalni i medijastinalni poremećaji
- Poremećaji nervnog sistema
- Belova paraliza
- Guillain Barré sindrom
- Poremećaji mišićno-skeletnog sistema i vezivnog tkiva
- Infekcije i zaraze
- Gastrointestinalni poremećaji
- itd.
“ Preosetljivost na aktivne supstance ili na bilo koju od pomoćnih supstanci navedenih u odeljku 6.1 ili na bilo
koju supstancu koja može biti prisutna u tragovima kao što su jaja (ovalbumin i kokošiji proteini), neomicin,
formaldehid i oktoksinol 9.
Vakcinaciju treba odložiti u slučaju umerene ili teške bolesti praćene groznicom ili akutne bolesti. ”
“ Kao i sa svim vakcinama koje se primenjuju injekcionim putem, potrebno je osigurati brzu dostupnost
odgovarajuće medicinske terapije i nadzor u slučaju anafilaktičke reakcije nakon primene vakcine. ”
“ Kao i sve ostale vakcine koje se primenjuju intramuskularno, ovu vakcinu treba pažljivo primeniti
pacijentima sa trombocitopenijom ili poremećajem krvarenja, jer prilikom intramuskularne primene može
doći do krvarenja kod ovih pacijenata.
Sinkopa (nagli gubitak svesti) se može pojaviti nakon, ili čak pre, bilo koje vakcinacije kao psihološki
odgovor na injekcionu iglu. Potrebno je sprovesti procedure za sprečavanje povreda uzrokovanih naglim
gubitkom svesti i lečenje sinkope. „
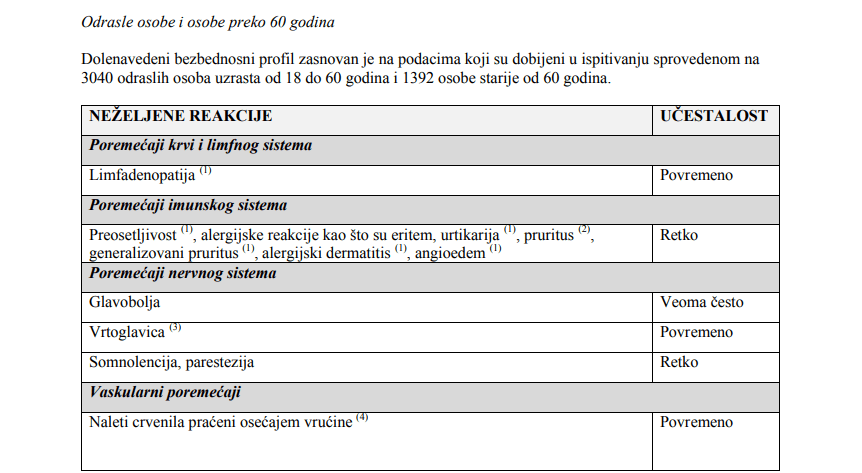
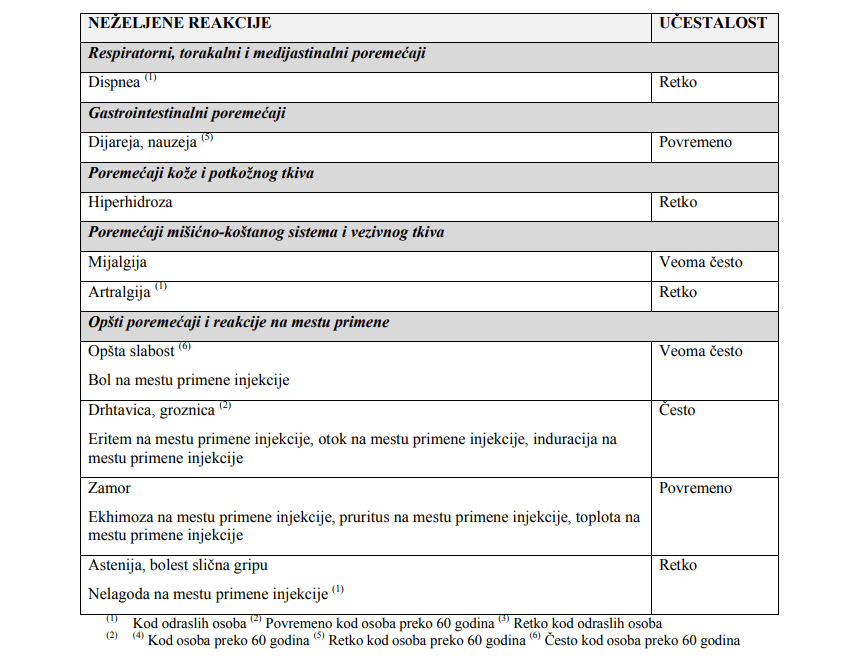
“ Najčešće prijavljivane neželjene reakcije nakon vakcinacije kod svih populacija bile su bol na mestu primene
injekcije (između 52,8% i 56,5% kod dece/adolescenata uzrasta od 3 do 17 godina i kod odraslih osoba;
25,8% kod osoba preko 60 godina).
Ostale najčešće prijavljene neželjene reakcije nakon vakcinacije bile su:
– kod odraslih osoba: glavobolja (27,8%), mijalgija (23%) i opšta slabost (19,2%),
– kod osoba preko 60 godina: glavobolja (15,6%) i mijalgija (13,9%),
– kod dece/adolescenata uzrasta od 9 do 17 godina: mijalgija (29,1%), glavobolja (24,7%), opšta slabost
(20,3%) i oticanje na mestu primene injekcije (10,7%),
– kod dece uzrasta od 3 do 8 godina: opšta slabost (30,7%), mijalgija (28,5%), glavobolja (25,7%), oticanje
na mestu primene injekcije (20,5%), eritem na mestu primene injekcije (20,4%), otvrdnuće na mestu primene
injekcije (16,4%), drhtavica (11,2%).
Sveukupno, neželjena dejstva su generalno bila ređa kod osoba preko 60 godina nego kod odraslih i
dece/adolescenata uzrasta od 3 do 17 godina. ”

“ Bezbednosni profil vakcine VaxigripTetra kod dece uzrasta od 3 do 8 godina bio je sličan nakon prve i druge
injekcije.
c. Moguće neželjene reakcije
Nema bezbednosnih podataka o vakcini VaxigripTetra nakon njenog stavljanja u promet.
Međutim, sledeće neželjene reakcije prijavljene su za vakcinu Vaxigrip za vreme kliničkih ispitivanja ili
nakon stavljanja vakcine u promet i mogu se pojaviti kod osoba koje su primile vakcinu VaxigripTetra.
– Poremećaji imunskog sistema
Teške alergijske reakcije: šok
Alergijske reakcije: osip, generalizovani eritem
– Poremećaji nervnog sistema
Guillain-Barré sindrom (GBS), neuritis, neuralgija, konvulzije, encefalomijelitis
– Vaskularni poremećaji
Vaskulitis kao što je Henoch-Schönlein purpura, u nekim slučajevima povezani sa prolaznim zahvatanjem
bubrega
d. Ostale posebne populacije
Bezbednosni profil vakcine VaxigripTetra praćen tokom kliničkog ispitivanja na ograničenom broju
ispitanika sa komorbiditetima ne razlikuje se od onog koji je primećen u opštoj populaciji. Takođe,
ispitivanja sprovedena sa vakcinom Vaxigrip nisu pokazala veće razlike u bezbednosnom profilu kod
ispitanika kojima je transplantiran bubreg i kod astmatičnih pacijenata.
Prijavljivanje neželjenih reakcija
Prijavljivanje sumnji na neželjene reakcije posle dobijanja dozvole za lek je važno. Time se omogućava
kontinuirano praćenje odnosa koristi i rizika leka. Zdravstveni radnici treba da prijave svaku sumnju na
neželjene reakcije na ovaj lek Agenciji za lekove i medicinska sredstva Srbije (ALIMS):
Agencija za lekove i medicinska sredstva Srbije
Nacionalni centar za farmakovigilancu ”
“ VaxigripTetra omogućava aktivnu imunizaciju protiv četiri soja virusa gripa (dva A podtipa i dva B podtipa)
koji su sadržani u vakcini.
VaxigripTetra indukuje stvaranje humoralnih antitela protiv hemaglutinina unutar 2 do 3 nedelje.
Ova antitela neutrališu virus influence.
VaxigripTetra je predviđen da pruži zaštitu od onih sojeva virusa influence od kojih je vakcina proizvedena.
Kao i kod svih vakcina, vakcinacija VaxigripTetra vakcinom možda neće zaštititi sve vakcinisane osobe.
Specifični nivoi titra antitela inhibicije hemaglutinacije (engl. hemagglutination-inhibition, IH) nakon
vakcinacije inaktivisanom vakcinom protiv virusa gripa nisu povezani sa zaštitom od gripa, ali titar antitela
IH korišćen je kao mera aktivnosti vakcine. U nekim ispitivanjima na ljudima, titar antitela IH od ≥1:40 bio
je povezan sa zaštitom od gripa kod do 50% ispitanika. ”
Rezultati jedne studije su pokazali da iako stariji mogu imati veći titar antitela od mlađih osoba, ti titri ne moraju biti povezani sa zaštitom [11].
Štaviše, još uvek nisu potpuno jasni korelati zaštite u vezi sa ćelijskim populacijama nakon vakcinacije tako da se rezultati mogu ograničeno tumačiti. [12]
Studija koja pokazuje da je vakcinacija protiv gripa u tekućoj i prethodnoj sezoni stvorila slične nivoe zaštite, a zaštita izazvana vakcinom bila je najveća za osobe koje se nisu vakcinisale tokom prethodnih 5 godina. [13]
Što se tiče starijih osoba, primećuje se progresivan pad humoralnog i ćelijskog imunog odgovora (imunosenescencija) prema infekcijama i vakcinacijama. [14]
Ubrizgane vakcine protiv gripa imaju mali zaštitni učinak protiv gripa i oboljenja sličnih gripu. [15]
Povećani rizik od infekcija respiratornim virusima povezan sa primanjem inaktivisane vakcine protiv gripa. [16]
Vakcina protiv gripa VaxigripTetra
Šta treba znati?
Šta treba znati?
Sanofijeva vakcina protiv gripa – VaxigripTetra vakcina protiv gripa – Šta treba znati?

Ugovorene količine vakcine protiv gripa za sezonu 2020/21
Srbija
-
Za uzrast
od 6-36 meseci
(1 000 doza)
Vaxigrip Tetra® (SANOFI PASTEUR) -
Za lica
starija od 3 godine
(343 920 doza)
Influvac® Tetra (ABBOTT BIOLOGICALS B.V.)
Crna Gora (31 000 doza)
Vaxigrip Tetra® (SANOFI PASTEUR)
BIH (23 500 doza)
Vaxigrip Tetra® (SANOFI PASTEUR)
Hrvatska (940 000 doza)
Vaxigrip Tetra® (SANOFI PASTEUR)
Vaxigrip Tetra® je četvorovalentna split vakcina (sadrži 4 soja fragmentisanog inaktivisanog virusa) odobrena u Evropi 2016. godine za osobe starije od 3 godine, naslednica trovalentne Vaxigrip® vakcine. [1] [2] [3] [4]
“ Ovaj lek je pod dodatnim praćenjem. Time se omogućava brzo otkrivanje novih bezbednosnih
informacija. Zdravstveni radnici treba da prijave svaku sumnju na neželjene reakcije na ovaj lek. Za način
prijavljivanja neželjenih reakcija videti odeljak 4.8. ”
– Ovo je prva rečenica na koju ćete naići ako pročitate SAŽETAK KARAKTERISTIKA LEKA.
“ VaxigripTetra je indikovan za aktivnu imunizaciju odraslih i dece od 3 godine i starije, za prevenciju
influence uzrokovane sa dva podtipa influenca A virusa i dva podtipa influenca B virusa sadržana u vakcini.
Primena VaxigripTetra vakcine treba da bude zasnovana na zvaničnim nacionalnim preporukama. ”
– Poslednji datum revizije teksta je Novembar, 2018. godine.
U međuvremenu su urađene studije nad decom uzrasta od 6 meseci i starijom. [5] [6] [7]
S druge strane, sprečavanje infekcije sezonskim virusima gripa vakcinacijom može sprečiti indukciju heterosubtipskog imuniteta na sojeve pandemije, što bi mogao biti nedostatak za imunološki naivne osobe – npr. Odojčad. [8]
“ Trudnoća
Inaktivisana vakcina protiv gripa se može koristiti u svim stadijumima trudnoće. Za drugi i treći trimestar su
raspoloživi obimniji podaci o bezbednosti u odnosu na prvi trimestar; ipak, podaci o primeni inaktivisane
vakcine protiv gripa širom sveta ne ukazuju na bilo kakva štetna dejstva vakcinacije za plod ili majku.
Nema dostupnih podataka o primeni vakcine VaxigripTetra kod trudnica. ”
U međuvremenu je urađena studija. [9]
Međutim,u periodu od 2010-2016. godine prijavljivani su neželjeni događaji kod trudnica nakon primanja vakcine protiv gripa. [10]
Prijavljivani su:
- Spontani pobačaji
- Mrtvorođeno dete
- Fetalna smrt (gestacijska starost nepoznata)
- Prevremeni porođaj
- Preeklampsija / hipertenzija izazvana trudnoćom
- Vaginalno krvarenje
- Poremećaji imunološkog sistema
- Anafilaksija
- Ne-anafilaksične alergijske reakcije
- Respiratorni, torakalni i medijastinalni poremećaji
- Poremećaji nervnog sistema
- Belova paraliza
- Guillain Barré sindrom
- Poremećaji mišićno-skeletnog sistema i vezivnog tkiva
- Infekcije i zaraze
- Gastrointestinalni poremećaji
- itd.
“ Preosetljivost na aktivne supstance ili na bilo koju od pomoćnih supstanci navedenih u odeljku 6.1 ili na bilo
koju supstancu koja može biti prisutna u tragovima kao što su jaja (ovalbumin i kokošiji proteini), neomicin,
formaldehid i oktoksinol 9.
Vakcinaciju treba odložiti u slučaju umerene ili teške bolesti praćene groznicom ili akutne bolesti. ”
“ Kao i sa svim vakcinama koje se primenjuju injekcionim putem, potrebno je osigurati brzu dostupnost
odgovarajuće medicinske terapije i nadzor u slučaju anafilaktičke reakcije nakon primene vakcine. ”
“ Kao i sve ostale vakcine koje se primenjuju intramuskularno, ovu vakcinu treba pažljivo primeniti
pacijentima sa trombocitopenijom ili poremećajem krvarenja, jer prilikom intramuskularne primene može
doći do krvarenja kod ovih pacijenata.
Sinkopa (nagli gubitak svesti) se može pojaviti nakon, ili čak pre, bilo koje vakcinacije kao psihološki
odgovor na injekcionu iglu. Potrebno je sprovesti procedure za sprečavanje povreda uzrokovanih naglim
gubitkom svesti i lečenje sinkope. „
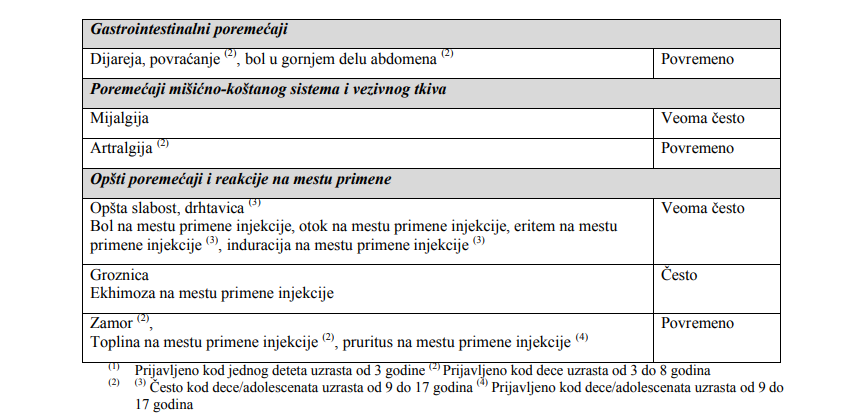
“ Najčešće prijavljivane neželjene reakcije nakon vakcinacije kod svih populacija bile su bol na mestu primene
injekcije (između 52,8% i 56,5% kod dece/adolescenata uzrasta od 3 do 17 godina i kod odraslih osoba;
25,8% kod osoba preko 60 godina).
Ostale najčešće prijavljene neželjene reakcije nakon vakcinacije bile su:
– kod odraslih osoba: glavobolja (27,8%), mijalgija (23%) i opšta slabost (19,2%),
– kod osoba preko 60 godina: glavobolja (15,6%) i mijalgija (13,9%),
– kod dece/adolescenata uzrasta od 9 do 17 godina: mijalgija (29,1%), glavobolja (24,7%), opšta slabost
(20,3%) i oticanje na mestu primene injekcije (10,7%),
– kod dece uzrasta od 3 do 8 godina: opšta slabost (30,7%), mijalgija (28,5%), glavobolja (25,7%), oticanje
na mestu primene injekcije (20,5%), eritem na mestu primene injekcije (20,4%), otvrdnuće na mestu primene
injekcije (16,4%), drhtavica (11,2%).
Sveukupno, neželjena dejstva su generalno bila ređa kod osoba preko 60 godina nego kod odraslih i
dece/adolescenata uzrasta od 3 do 17 godina. ”




“ Bezbednosni profil vakcine VaxigripTetra kod dece uzrasta od 3 do 8 godina bio je sličan nakon prve i druge
injekcije.
c. Moguće neželjene reakcije
Nema bezbednosnih podataka o vakcini VaxigripTetra nakon njenog stavljanja u promet.
Međutim, sledeće neželjene reakcije prijavljene su za vakcinu Vaxigrip za vreme kliničkih ispitivanja ili
nakon stavljanja vakcine u promet i mogu se pojaviti kod osoba koje su primile vakcinu VaxigripTetra.
– Poremećaji imunskog sistema
Teške alergijske reakcije: šok
Alergijske reakcije: osip, generalizovani eritem
– Poremećaji nervnog sistema
Guillain-Barré sindrom (GBS), neuritis, neuralgija, konvulzije, encefalomijelitis
– Vaskularni poremećaji
Vaskulitis kao što je Henoch-Schönlein purpura, u nekim slučajevima povezani sa prolaznim zahvatanjem
bubrega
d. Ostale posebne populacije
Bezbednosni profil vakcine VaxigripTetra praćen tokom kliničkog ispitivanja na ograničenom broju
ispitanika sa komorbiditetima ne razlikuje se od onog koji je primećen u opštoj populaciji. Takođe,
ispitivanja sprovedena sa vakcinom Vaxigrip nisu pokazala veće razlike u bezbednosnom profilu kod
ispitanika kojima je transplantiran bubreg i kod astmatičnih pacijenata.
Prijavljivanje neželjenih reakcija
Prijavljivanje sumnji na neželjene reakcije posle dobijanja dozvole za lek je važno. Time se omogućava
kontinuirano praćenje odnosa koristi i rizika leka. Zdravstveni radnici treba da prijave svaku sumnju na
neželjene reakcije na ovaj lek Agenciji za lekove i medicinska sredstva Srbije (ALIMS):
Agencija za lekove i medicinska sredstva Srbije
Nacionalni centar za farmakovigilancu ”
“ VaxigripTetra omogućava aktivnu imunizaciju protiv četiri soja virusa gripa (dva A podtipa i dva B podtipa)
koji su sadržani u vakcini.
VaxigripTetra indukuje stvaranje humoralnih antitela protiv hemaglutinina unutar 2 do 3 nedelje.
Ova antitela neutrališu virus influence.
VaxigripTetra je predviđen da pruži zaštitu od onih sojeva virusa influence od kojih je vakcina proizvedena.
Kao i kod svih vakcina, vakcinacija VaxigripTetra vakcinom možda neće zaštititi sve vakcinisane osobe.
Specifični nivoi titra antitela inhibicije hemaglutinacije (engl. hemagglutination-inhibition, IH) nakon
vakcinacije inaktivisanom vakcinom protiv virusa gripa nisu povezani sa zaštitom od gripa, ali titar antitela
IH korišćen je kao mera aktivnosti vakcine. U nekim ispitivanjima na ljudima, titar antitela IH od ≥1:40 bio
je povezan sa zaštitom od gripa kod do 50% ispitanika. ”
Rezultati jedne studije su pokazali da iako stariji mogu imati veći titar antitela od mlađih osoba, ti titri ne moraju biti povezani sa zaštitom [11].
Štaviše, još uvek nisu potpuno jasni korelati zaštite u vezi sa ćelijskim populacijama nakon vakcinacije tako da se rezultati mogu ograničeno tumačiti. [12]
Studija koja pokazuje da je vakcinacija protiv gripa u tekućoj i prethodnoj sezoni stvorila slične nivoe zaštite, a zaštita izazvana vakcinom bila je najveća za osobe koje se nisu vakcinisale tokom prethodnih 5 godina. [13]
Što se tiče starijih osoba, primećuje se progresivan pad humoralnog i ćelijskog imunog odgovora (imunosenescencija) prema infekcijama i vakcinacijama. [14]
Ubrizgane vakcine protiv gripa imaju mali zaštitni učinak protiv gripa i oboljenja sličnih gripu. [15]
Povećani rizik od infekcija respiratornim virusima povezan sa primanjem inaktivisane vakcine protiv gripa. [16]